许多被称作核RNA结合蛋白(RBP)的特殊分子,当错误地被放置在细胞核外面时,会形成包括额颞叶痴呆症(FTD)和肌性脊髓侧索硬化症(ALS)在内的几种脑部疾病中观察到的有害蛋白团块。由这些致病性蛋白形成的团块含有导致神经细胞损伤的粘性原纤维。为此,人们想要逆转这些团块的形成,并将RBP蛋白重新放回细胞核内的适当位置上。
在正常情形下,核输入受体(nuclear-import receptor, NIR)结合到RBP蛋白的特定氨基酸序列上,引导它们进入细胞核。在一项新的研究中,美国宾夕法尼亚大学佩雷尔曼医学院的生物化学与生物物理学副教授James Shorter博士及其团队描述了当将NIR添加到由蛋白TDP-43和FUS形成的聚集物中时,会发生什么,其中蛋白TDP-43和FUS与这些神经退行性疾病相关联。
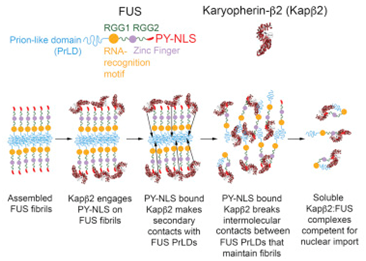
论文共同作者Lin Guo博士说,“当我们增加NIR浓度时,有三个重要且令人惊讶的结果出现了。”首先,在试管实验中,RBP蛋白团块溶解了。其次,NIR也会溶解细胞质中的蛋白团块,并让功能性RBP蛋白返回到细胞核中。后,当果蝇疾病模型中增加NIR表达时,它们的寿命延长,而且它们的神经退化下降了。
这些研究人员发现NIR能够很快地逆转FUS和TDP-43蛋白团块形成。RBP在溶液中溶解并形成液滴状结构通常是在细胞核内发生的,也是RBP蛋白功能的一个正常的组成部分。然而,当诸如FUS和TDP-43之类的RBP蛋白被错误地放置在细胞质中时,这种相变发生异常,从而使得这些RBP蛋白形成破坏性的粘性原纤维,这能够利用NIR蛋白加以校正。但是,NIR蛋白的表达或活性很可能在疾病中下降了。
论文共同作者、Shorter实验室博士生Charlotte Fare说,“考虑到这种复杂性,我们如今正在努力寻找一种方法来增加NIR蛋白在具有蛋白团块的神经元中的表达,比如利用基因工程方法或小分子药物
请输入账号
请输入密码
请输验证码
以上信息由企业自行提供,信息内容的真实性、准确性和合法性由相关企业负责,智慧城市网对此不承担任何保证责任。
温馨提示:为规避购买风险,建议您在购买产品前务必确认供应商资质及产品质量。